Introduktion
Vores fysiologi har igennem evolutionen udviklet sig til at kunne håndtere mange forskellige typer madvarer, og derved er kroppen blevet udrustet med evnen til at kunne håndtere indflydelsen af en varieret kost på syre/base-balancen. Det er netop denne evne, som bliver udfordret i vores moderne kultur, når kosten bliver ensformig, eller når man følger en bestemt kostplan, der indskrænker tilgangen til et bredt næringsgrundlag.
Syre/base-balancen har været et omdrejningspunkt for mange behandleres tilgang til en sygdomsforståelse, hvor både kost og livsstil sættes i fokus. Der er skrevet mange bøger om emnet gennem de sidste fem årtier, og adskillige forfattere har fremsat deres egen vinkel på fænomenet med forskellige fortolkninger og forklaringer: Nogle har skrevet om blodets pH-værdi, andre om bindevævets pH-værdi – og næsten alle har skrevet om, hvordan kosten kan opdeles i syredannende og basedannende madvarer. Måske har en af grundene til, at syre/base-balancen har fået bred anerkendelse, været det faktum, at en simpel objektiv hjemmetest, nemlig måling af urinens surhedsgrad, kan afsløre, om behandlingsstrategien er på rette kurs. Ligesom mange andre trends kommer fortællingen om syre/base-balancen tilbage i søgelyset med jævne mellemrum og bliver genoptaget som en populær behandlingsmodel af en ny generation af behandlere.

En kost, der fokuserer på de såkaldt basedannende madvarer, vil i de fleste tilfælde bidrage med en positiv indflydelse på sundheden, da de fleste madvarer, der omtales som basedannende, kan betragtes som sunde. Men om sundhedsbidraget skal forklares på basis af madens basedannende egenskaber, næringsstofindhold eller et særligt indholdsstof, vil altid være til diskussion. Således blev det i en undersøgelse om basedannende kost konkluderet, at en kostplan baseret på hypotesen om kostens indflydelse på syre/base-balancen faktisk havde en sundhedsfremmende virkning i kraft af en forbedring af både kroppens natrium/kalium-balance og cellernes enzymfunktion.
Et af de syrlige stoffer, som omtales ofte i forhold til syrebelastning og sundhed, er urinsyre, hvor fortællingen om podagra har været en tilbagevendende favorit blandt undervisere i sygdomslære. Nyere forskning har genbesøgt urinsyre i forhold til, hvordan den påvirker vores fysiologi, og den nye viden skaber en overraskende og dyster fortælling om urinsyrens rolle i udviklingen af mange moderne livsstilssygdomme. De mekanismer, der knytter urinsyre til sygdomsudvikling, samt de tiltag, der skal til for at modvirke dem, forener to populære behandlingstilgange: Syre/base-balance og anti-inflammatorisk kost.
Denne artikel er et forsøg på at se på forskellige aspekter af syre/base-balancen, dens indflydelse på vores kropsvæv, og hvordan der kan opstå potentielle skadelige virkninger, når reguleringsmekanismerne bliver overbebyrdede. Urinsyres rolle i udvikling af livsstilssygdomme diskuteres også i lyset af syre/base-balancen og dens forbindelse til kronisk inflammationsudvikling og metabolisk dysregulering.
Surhedsgrad (pH)
| Surhedsgrad er en kemisk enhed, der anvendes inden for fysiologien. Måleenheden for surhed er pH, hvor p står for potential og H for hydrogen (brint). Konceptet pH blev først introduceret af den danske kemiker Søren Peder Lauritz Sørensen (1868 – 1939), som var chef på Carlsberg-laboratoriet.
pH-værdien angiver koncentrationen af brintioner i en opløsning. En brintion er et hydrogen-atom med en positiv ladning (H+). Den egentlige definition på måleenheden pH er meget indviklet, men det er et tal mellem 1 og 14, hvor pH 7,0 betragtes som neutral og svarer til antallet af brintioner i rent vand, og hvor alt over syv er basisk, og alt under syv er surt. På den mest basiske del af skalaen kan der nævnes f.eks. klor med en pH på ca. 13,0, og i den anden ende af skalaen mavesyre med en pH på mellem 1,0 – 3,0 (se Figur 1).
Måling af pH kan foretages med et elektronisk pH-måleinstrument eller ved hjælp af UI (Universalindikator) papir, som skifter farve efter pH-værdien. Skalaen, der bruges til beregning af opløsningers pH-værdier, er en såkaldt logaritmisk skala. pH-værdien angiver den negative logaritme til koncentrationen af brintioner i en opløsning. pH-værdien af en opløsning beregnes ud fra koncentrationen af brintioner efter følgende formel: pH = -log (H+-koncentrationen) hvor koncentrationen angives i mol/l (eller molær). Rent vand med pH på 7,0 er neutralt og har derfor en koncentration af brintioner på 10-7 mol/L, eller 0,0000001 mol/L. Klor har med en pH på 13,0 en koncentration af brintioner på 10-13 mol/L, eller 0,0000000000001 mol/L (den negative logaritme angiver antallet af decimaler). Det er også vigtigt at forstå, at når måleenheden er angivet logaritmisk, betyder det, at en opløsning med en pH på 4,0 indeholder ti gange flere brintioner end en opløsning med en pH på 5,0. Ligeledes har en opløsning med en pH på 3,0 ti gange flere brintioner end en opløsning med en pH på 4,0. |
Der har været – og er stadig i nogle fora – en del diskussion om, hvordan syre-basebalancen egentlig skal forstås i forhold til kroppens fysiologi. Et godt udgangspunkt er forståelsen af begreberne syre og base, så lad os begynde med det.
Måleenheden for surhedsgrad er pH, som står for potential hydrogen (hydrogen er den kemiske betegnelse for brint), der angiver antallet af frie, positivt ladede brintatomer i en opløsning som en negativ logaritme, hvor 1 indikerer mange frie ioner, og 14 indikerer færre frie ioner (se boksen på næste side for en mere dybtgående forklaring). Et surt stof er således et stof, der frigiver brintioner, når det kommer i en opløsning. Som tidligere nævnt er der skrevet og talt en del om blodets pH-værdi i forhold til syre/base-balancen, men ud fra en sundhedsvidenskabelig betragtning står det klart, at blodets pH-værdi er og bliver stabil inden for meget snævre grænser, hvor selv små afvigelser kan have katastrofale konsekvenser for sundheden. Blodet har en normal pH-værdi på 7,4, og der er tale om normale grænser på plus og minus 0,05. Målinger uden for disse grænser betragtes som enten acidose (pH-niveauet er mindre end 7,35) eller alkalose (pH-niveauet er større end 7,45). Begge disse tilstande kan være livstruende, og en acidose med en pH-værdi på under 6,8 anses for at være uforenelig med livet i klinisk forstand.
Vigtige pH buffer- og reguleringsmekanismer
I den levende krop er der mange almindelige faktorer, som hvert sekund resulterer i frigørelse af frie brintioner til blodbanen. Et eksempel er kroppens metaboliske aktivitet, der er grundlaget for bl.a. transmission af nervesignaler, muskelkontraktion og cellerespiration, og som skaber frie brintioner, der har potentiale til at reducere blodets pH (Hopkins et al. 2022). Heldigvis har kroppen nogle såkaldte buffer- og reguleringsmekanismer, der er i stand til at binde frie brintioner, når blodets pH falder (bliver mere syrligt) og frigive dem, når blodets pH stiger (bliver mere basisk). Derved kan blodets pH-værdi holdes inden for de førnævnte kritiske grænser. Forenklet sagt er en buffer et stof eller en mekanisme, som minimerer ændringer i koncentrationen af frie brintioner i en opløsning, når brintioner enten er tilført eller fjernet (Brown 1965). Det skal dog siges, at kapaciteten af kroppens buffermekanismer er begrænset, og hvis disse begrænsninger overstiges, kan det have skadelige følger. I den følgende tekst præsenteres en oversigt over nogle af kroppens vigtige buffer- og reguleringsmekanismer.
Bikarbonat/kulsyre-buffermekanismen
Blodet indeholder bikarbonat (HCO3–) – et negativt ladet stof, der er dannet fra kulsyre (H2CO3), som selv er dannet af kuldioxid (CO2) og vand (H2O). Formlen herunder viser den kemiske reaktion, hvorved der dannes bikarbonat.
CO2 + H2O ⇌ H2CO3 ⇌ HCO3– + H+
kuldioxid + vand ⇌ kulsyre ⇌ bikarbonat + brintion
Det kan ses fra formlen, at dannelse af bikarbonat fra kulsyre sker ved frigørelse af en fri brintion (H+). Brintionen er angivet med et efterfølgende plus, da den er positivt ladet.
Nu tænker I måske: Hvordan kan en reaktion, der skaber frie brintioner og derved et potentielt syrligt miljø, fungere som en buffer, der kan fjerne frie brintatomer fra blodet? Svaret ligger i det faktum, at reaktionen er en såkaldt bufferreaktion og kan køres baglæns (som vist med de tovejsrettede pile i ovenstående formel). Ved at se på reaktionen fra højre mod venstre kan frie brintioner (H+) binde sig til bikarbonat (HCO3–) og danne kulsyre, som efterfølgende kan nedbrydes til kuldioxid og vand. I kroppen fjernes kuldioxid fra blodet ved udånding, og derved er den frie brintion blevet bundet i et vandmolekyle og kan ikke længere bidrage til et skabe et syrligt miljø i blodbanen (Brinkman and Sharma 2022; Patel and Sharma 2022). Hvis der er brug for at regulere blodets pH-værdi i den modsatte retning og øge antallet af frie brintioner ved et potentielt fald i brintionkoncentration, hvilket kan ske ved f.eks. hyperventilation pga. øget udskillelse af kuldioxid, kan reaktionen køre i den modsatte retning (fra venstre mod højre). De symptomer, der opleves ved hyperventilation, såsom svimmelhed, prikken i fingrene og andre føleforstyrrelser, skyldes en stigende pH-værdi i blodet (faldende koncentration af brintioner), hvor blodet bliver mere basisk, da den beskrevne reaktion kører kraftigt fra højre mod venstre på grund af en øget udskillelse af kuldioxid.
Symptomerne ved hyperventilation kan kompenseres ved at ånde ud og ind i en pose – derved bliver det udskilte kuldioxid genoptaget via lungerne, hvorefter blodets kuldioxidkoncentration stiger. Dette skubber ovenstående reaktion fra venstre mod højre, hvor brintioner ender med at blive frigivet til blodet, som kompenserer for det tab, der er sket ved hyperventilationen.
Ovenstående eksempel med hyperventilation viser, hvordan bikarbonat/kulsyre-buffermekanismen virker i en ekstrem situation, men ved normale kropslige tilstande sker der ubevidst ændringer i både åndedrættets dybde og hastighed, som finregulerer blodets pH-værdi i forhold til normale dynamiske ændringer i produktionen af brintioner.
Røde blodlegemer og hæmoglobin som buffer
Eksemplet herover viser, at kuldioxid spiller en væsentlig rolle i forhold til blodets syre/base-balance, og der er flere buffermekanismer, hvor kuldioxid indgår. En af dem involverer røde blodlegemer og hæmoglobin.
Som tidligere forklaret vil en stigende koncentration af kuldioxid have en tendens til at gøre blodet mere syrligt ved at skubbe bufferreaktionen præsenteret ovenfor fra venstre mod højere, hvorved der bliver skabt flere brintioner. Kuldioxid (CO2) kan dog ved stigende koncentration i blodet diffundere over de røde blodlegemers cellemembraner ind i cellerne og forbinde sig med vand (H2O) i en reaktion, der ligner bikarbonat/kulsyre-mekanismen, hvor der skabes kulsyre (H2CO3). Inde i de røde blodlegemer dissocierer (adskilles) kulsyre, hvorved der dannes bikarbonat (HCO3–) og brintioner (H+) (Samuel 2019).
CO2 + H2O à H2CO3 à HCO3– + H+
kuldioxid + vand à kulsyre à bikarbonat + brintion
Brintionerne bliver bundet til hæmoglobin og er derved forhindret i at have indflydelse på blodets pH-værdi (karakteriseret ved en stigende brintion-koncentration).

Kuldioxid kan dog også direkte bindes af hæmoglobin ved en stigende koncentration af kuldioxid i blodet. Derved skabes et scenarie, hvor kuldioxid fjernes fra blodet og forhindrer, at bufferreaktionen skubbes i retningen venstre mod højere, hvor der ellers ville blive skabt flere brintioner, der ville forårsage et fald i blodets pH-værdi.
Nyrernes rolle i syre- basereguleringen
De førnævnte mekanismer er i stand til at finregulere potentielle stigninger og fald i blodets pH-værdi i forhold til umiddelbare minut-for-minut dynamiske udfordringer inden for visse grænser. Men buffermekanismerne kan ikke fjerne ophobede metaboliske syrestoffer fra kroppen eller kompensere for en livstruende alkalose-tilstand, der overstiger buffermekanismens grænse. Her spiller nyrerne en væsentlig rolle, da de i normale situationer kan skabe et reguleret baggrundsmiljø, over hvilket de ovenfornævnte buffermekanismer arbejder for at finjustere syre/base-balancen i forhold til dynamiske metaboliske ændringer.
De førnævnte buffermekanismer har til opgave at finregulere potentielle stigninger og fald i blodets
pH-værdi i forhold til umiddelbare minut-for-minut dynamiske ændringer. Det er dog nyrerne, som skaber en grundtilstand i blodet, der danner et baggrundsmiljø, over hvilket buffermekanismer kan bistå finreguleringen. I forhold til denne opgave har nyrerne to hovedfunktioner:
- Genoptagelse af bikarbonat
- Dannelse af bikarbonat
Disse to hovedfunktioner involverer mange komplekse trin, og den følgende tekst giver et overblik over hovedelementerne i processerne.
Bikarbonatdannelsesfunktionen i nyrerne involverer to andre mekanismer, der også bidrager til styring af syre/base-balancen, nemlig dannelse af ammoniak og udskillelse af brintioner (H+) (Weiner and Verlander 2013). Ammoniakdannelse (ammoniagenesis) er et godt udgangspunkt for at forstå sammenhængen mellem disse mekanismer.
Ammoniakdannelse foregår i alle epitelceller (dækvævsceller) i nyrernes tubulussystem, men i særdeleshed er epitelceller i den proksimale tubulus afgørende i forhold til en produktionsmængde, som kan have en indflydelse på syre/base-balancen.
Udgangspunktet for ammoniakdannelsen er aminosyren glutamin:
C5H10N2O3
I epitelcellerne bliver glutamin via en række kemiske processer metaboliseret til ammoniak og bikarbonat. Det nydannede bikarbonat bliver transporteret fra epitelcellerne ind i blodbanen (se Figur 2), hvor det indgår i bikarbonat/kulsyre-buffermekanismen, som er omtalt ovenfor.
Det nydannede ammoniakmolekyle kan eksistere i to former: Som ammoniak (NH3) eller som en ammoniakion (NH4+). I ammoniakion-formen blev der bundet en positivt ladet brintion, og derved bliver ammoniakionens nettoladning også positiv. Koncentrationsforholdet mellem de to ammoniakformer er afhængigt af en bufferreaktion, som ligner den tidligere viste tovejs-bufferreaktion, hvor der i den ene retning forbindes en brintion i dannelsen af en ny molekylestruktur, og hvor der i den anden retning frigøres en brintion. Husk, at syre/base-forholdet handler om antallet af frie brintioner.
Ammoniak/ammoniakion-bufferreaktionen ser således ud:
NH3 + H+ ⇌ NH4+
Ammoniak + brintion ⇌ Ammoniakion
Figur 2.
Som det ses fra reaktionsformlen, kan dannelsen af et ammoniakmolekyle binde en fri brintion (H+), og dermed skabes potentialet til at øge pH-værdien (øget basetilstand) (Weiner and Verlander 2013). Den bufferreaktion, der foregår i epitelcellerne i nyrernes tubulussystem, skaber en dynamisk fleksibilitet, som ved at adaptere til et ændret syre/base-forhold i kroppen kan bidrage til regulering af kroppens syre/base-balance og skabe mulighed for at udskille brintioner fra kroppen.
Ammoniakioner kan udskilles fra epitelceller ind i præurinen i nyrernes tubulussystem. Dermed bliver de brintioner, der var bundet til ammoniak for at danne en ammoniakion, fjernet fra kroppen. Som nævnt tidligere er denne udskillelsesmekanisme forbundet med optagelse af bikarbonat fra nyrernes tubulussystem, der skyldes aktivering af et specifikt enzym (H+-K+-ATPase) (Frank et al. 2000). Forbindelsen mellem optagelse af bikarbonat til epitelcellerne og udskillelse af brintionen fra epitelcellerne under indflydelse H+-K+-ATPase er illustreret i Figur 2 ved de grønne markeringer. Produktionen af ammoniak i tubulussystemets epitelceller opreguleres som respons på en stigende brintionkoncentration i blodet (øget surhed) (Skelton et al. 2010) samt ved en faldende pH-værdi i urinen (øget surhed) (Anon 2022).
Set fra et syre/base-reguleringssynspunkt vil den faldende pH-værdi i blodet (øget surhed) forårsage:
- Øget optagelse af bikarbonat
- Øget ammoniakproduktion
- Øget udskillelse af brintioner
En stigende pH-værdi i blodet (øget basetilstand) vil forårsage:
- Nedsættelse af udskillelsen af brintioner
- Nedsættelse af bikarbonatoptagelsen – og dermed nedsat udskillelse af brintioner
Nyrernes bidrag til syre/base-regulering har en stor betydning for kroppens indre syre/base-miljø. Samtidig står nyrerne – i deres rolle som udskillelsesorgan – i frontlinjen, når det drejer sig om ophobede metaboliske syrestoffer. Heldigvis er nyrernes udskillelseskapacitet tilstrækkelig til at kunne regulere de metaboliske syrestoffer, som skabes ved en normal, sund levevis, men overskrides denne kapacitet, kan nyrerne lide overlast, og der kan opstå kroniske nyresygdomme. Konsekvensen kan blive, at nyrernes syre/base-reguleringskapacitet nedsættes, og der igangsættes en negativ spiral, som i ekstreme tilfælde kan ende med nyresvigt.
Hovedpunkterne i nyrernes rolle i syre/base-reguleringen er:
- Dannelsen af ammoniak fra glutamin, hvorved der samtidig dannes bikarbonat
- Ammoniakdannelse og -udskillelse øger udskillelsen af brintioner
- Udskillelsen af brintioner er forbundet til genoptagelsen af bikarbonat
Knoglernes rolle i syre/base-balancen
Knoglernes rolle i syre/base-reguleringen blev første gang omtalt i 1968 i en artikel af Wachman og Bernstein (Wachman and Bernstein 1968), hvor de postulerede, at belastning af syre/base-balancen kunne være en af de patologiske mekanismer, der står bag udviklingen af osteoporose. I dag findes der en del forskning, der understøtter Wachman og Bernsteins teori og inddrager knoglernes fysiologi som en vigtig del af syre/base-balancens reguleringsmekanismer (Dawson-Hughes 2020).
Knoglestruktur består primært af calcium, fosfor og kollagen i en krystallinsk matrix, der også indeholder en stor del kuldioxid (CO2) bundet i form af karbonat (CO32-) og bikarbonat (H2CO3–) (Brandis 2022). Desuden er forskellige ionstoffer, karbonat og bikarbonat, til stede i knoglestrukturen, hvilket gør, at knoglerne kan medvirke som buffer i reguleringen af syre/base-balancen. Knoglernes buffermekanisme består af to processer:
- Optagelse af brintioner (H+)
- Frigørelse af karbonat (CO32-) og bikarbonat (H2CO3–)
Optagelsen af brintioner sker ved ombytning af calciumioner (Ca2+) i knoglestrukturen for brintioner (H+) (Bushinsky and Krieger 2015). Derved er brintionerne taget ud af kredsløbet, og blodets pH-værdi stiger (bliver mere basisk). Denne ombytning sker uden umiddelbar nedbrydning af knoglerne og involverer sandsynligvis intracellulære buffermekanismer (Brandis 2022). I modsætning til ombytning af brint- og calciumioner er buffermekansimen, der består af frigørelsen af karbonat og bikarbonat forbundet med nedbrydning af knoglestrukturen. Ved et fald i pH-værdien i blodet og dermed også i knoglevævets ekstracellulære væske aktiveres osteoklasterne – de knogleceller, der nedbryder knoglesubstansen – hvorved der frigives calciumioner, karbonat og bikarbonat (Arnett 2003). Det er frigivelsen af bikarbonat, der bidrager til syre/base-reguleringen, da det indgår i bikarbonat/kulsyre-buffermekanismen (se tidligere afsnit).
Syre/base-balancen i forhold til kroppens energikilder
Det er energi fra kosten, der driver kroppens fysiologiske processer – selve grundlaget for livet. Fra et ernæringsperspektiv får kroppen sin energitilførsel fra indtagelse og nedbrydning af kulhydrater, fedt og protein. Kroppen kan også udnytte energi fra alkoholindtag, men det er en uhensigtsmæssig og uholdbar løsning i forhold til en sund levevis.
Overordnet set kræver kulhydrat- og fedtmetabolismen tilførsel af ilt, og ved frigørelse af energien skabes der kuldioxid og vand. Ud fra den antagelse står det klart, at i forhold til den bikarbonat/kulsyre-buffermekanisme, der blev præsenteret tidligere er der tale om en proces, der er syreskabende, da kuldioxid og vand vil skubbe buffermekanismen i retning af brintiondannelse (fra venstre mod højre), men i en sund krop vil buffermekanismens kapacitet normalt ikke overstiges, og kroppen vil kunne regulere for brintiondannelse skabt ved indtagelse af fedt og kulhydrater:
CO2 + H2O ⇌ H2CO3 ⇌ HCO3– + H+
kuldioxid + vand ⇌ kulsyre ⇌ bikarbonat + brintion
Proteinmetabolisme har også en netto syreskabende indflydelse, hvor der dannes bl.a. saltsyre (HCl) og svovlsyre (H2SO4). Disse syrestoffer bliver hurtigt taget imod af en buffermekanisme, der involverer anvendelse af natrium (Na), hvorved der skabes natriumsalte (hhv. natriumklorid og natriumsulfat), kuldioxid og vand (se nedenfor). Nyrerne udskiller natriumsaltene, og kuldioxid og vand vil normalt håndteres af bikarbonat/kulsyre-buffermekanismen eller udskilles via lungerne (Koeppen 2009).
HCl + NaHCO3 → NaCl + CO2 + H2OH
saltsyre + natriumhydrogenkarbonat → natriumklorid + kuldioxid + vand
H2SO4 + 2NaHCO3 → Na2SO4 + 2CO2 + 2H2O
svovlsyre + 2 natriumhydrogenkarbonat → natriumsulfat + 2 kuldioxid + 2 vand
Ud fra dette kan man begynde at forstå, hvordan kosten kan påvirke buffermekanismernes og nyrernes håndteringskapacitet. Hos en relativt sund og rask person med en delvis fornuftig kost ser man normalt ikke umiddelbart konsekvenser af et belastet buffersystem. Men i tilfælde, hvor der opstår en svær belastning, kan der også opstå en såkaldt metabolisk acidose-tilstand, der kan give anledning til, at kroppen begynder uhensigtsmæssigt at anvende andre løsninger til at kontrollere en overskydende syrlig tilstand med den konsekvens, at der kan opstå en metabolisk acidose-relateret sygdomstilstand, der primært ses som gigt (Miklos and Agnes 2018). Dette er den klassiske fortælling om syre/base-balancen.
Nyere forskning er dog begyndt at anerkende, at selv om kroppens buffersystem arbejder inden for dets normale kapacitet, vil en kost, der over længere tid udfordrer buffersystemets evne til at opretholde en normal pH-værdi i blodet, forårsage kroniske, patologiske forandringer i knogle- og bindevævet (Vormann and Goedecke 2006). Dette scenarie – med et langvarigt overbebyrdet buffersystem – skaber en såkaldt latent acidose-tilstand, der typisk ses med stigende alder på grund af nedsat nyreaktivitet og et højt proteinindtag (Vormann and Goedecke 2002).
Det følgende afsnit indleder med en kort beskrivelse af de relativt almindelig forekommende anerkendte tilstande relateret til metabolisk acidose og fortsætter med en præsentation af betydningen af latent acidose i forhold til udvikling af kroniske, patologiske tilstand.
Syre/base-balancen i forhold til bindevæv og sygdomsudvikling
At metabolisk acidose-tilstande kan have en indflydelse på bindevævet, er en kendsgerning, som har haft plads i lærebøgerne i mange årtier, men her er der normalt kun tale om de såkaldt krystal-inducerede gigttilstande, som hovedsagelig omfatter podagra, pseudopodagra samt kalcificerende (forkalkende) tendinitis (Ralph Schumacher 1996). Disse tilstande er karakteriseret ved deponering af saltkrystaller i bindevævet og kan forbindes med ændringer i metabolismen af syrestoffer (Maiuolo et al. 2016; Ryan and McCarty 1995; Ankli et al. 2018). Tilstandene forårsager en lokal inflammationsrespons i vævet (Renaudin et al. 2020; Faure and Daculsi 1983) med smerter og funktionsnedsættelse i det pågældende led.
Podagra er karakteriseret ved deponering af mononatriumurat-krystaller i bl.a. i ledbrusk, ledbånd og sener
- Pseudopodagra er karakteriseret ved deponering af calciumpyrofosfat i ledbrusk og meniskstrukturer
- Kalcificerende tendinitis er karakteriseret ved kalcificering af sener med calciumapatit (også kaldt hydroxyapatit)
Der findes et mere omfattende, men skjult forhold mellem syre/base-balance og inflammationstilstand i forhold til kroppens bindevævsstrukturer, som antagelig involverer andre anatomiske strukturer ud over bevægeapparatet.
Bindevæv findes ikke kun i forbindelse med bevægeapparatstrukturer, men udgør en integreret del af alle kroppens vævsstrukturer, hvor det er med til at opretholde vævets mekaniske såvel som fysiologiske integritet. Denne proces sker gennem bindevævets indflydelse på vævcellernes organisering og dets indflydelse på vævcellernes metabolisme (Shekhter 1986; Park et al. 2016). Med andre ord er kropsvævene afhængige af et velfungerende bindevævsnetværk.
På det mikroskopiske plan består bindevævet af et netværk af forskellige typer proteinfibre, hvis sammensætning giver de forskellige bindevævstyper deres særlige mekaniske karakteristika (Yue 2014). Disse proteinfibre danner både en form for stillads, der skaber et fundament for vævsstrukturen, og giver form til vævcellernes ekstracellulære matrix (Frantz et al. 2010). Ud over de strukturelle proteinfibre består den ekstracellulære matrix hovedsagelig af vand og nogle polysakkarid/aminosyre-strukturer, kaldet proteoglykaner, som er forbundet til bindevævets proteinfibre.
Nyere forskning har undersøgt proteoglykanernes indflydelse på vævscellerne, og de overraskende resultater har drevet studiet af proteoglykaner til forkanten af moderne biomedicinsk forskning (Perrimon and Bernfield 2001). Proteoglykaner består af uforgrenede, sammenkædede sukkerstoffer (polysakkarider), aminosukker og uronsyre (Townsend 2022), som indgår i samlede kemiske strukturer, der indeholder mange negativt ladede kemiske grupper. Dette betyder, at proteoglykan-strukturen tiltrækker positivt ladede ioner såsom natrium (Na+), der tiltrækker vand – hvilket resulterer i, at vand bliver indlemmet i den ekstracellulære matrix, som bl.a. bidrager til at skabe bindevævets mekaniske egenskaber (Townsend 2022; Vormann and Goedecke 2006).
Tilstedeværelsen af de mange ladede kemiske grupper i proteoglykanernes molekylære opbygning betyder også, at deres struktur er følsom over for pH-ændringer, der afviger fra de normale grænser. En latent acidose-tilstand kan dermed bl.a. forstyrre proteoglykanernes evne til at binde vand, hvilke vil bl.a. have en umiddelbar indflydelse på bindevævets mekaniske egenskaber, som kan hæmme bindevævets normale funktion (Vormann and Goedecke 2006). I tilfælde hvor det pågældende bindevæv spiller en afgørende mekanisk funktionel rolle – f.eks. i ledbrusk og andre bindevævs ledstruktur – kan konsekvensen af en ændring i bindevævets mekaniske egenskaber resultere i funktionssvigt med efterfølgende udvikling af en lokal inflammationstilstand. Processen derfra vil være selvforstærkende, da inflammation forårsager en ændring i pH-værdien i lokalt væv mod en mere syrlig tilstand, som stimulerer produktion af interleukin-1β (IL-1β), som er en kraftfuld pro-inflammatorisk cytokin (Rajamäki et al. 2013).
Ud over at have indflydelse på vævets mekaniske egenskaber fungerer den ekstracellulære matrix som en biokemisk transitvej for vævscellernes forsyning med vand, næringsstoffer, ilt, kuldioxid og elektrolytter samt regulering og bortskaffelse af metaboliske produkter (Vormann and Goedecke 2006). Desuden agerer den ekstracellulære matrix som et reservoir for bioaktive stoffer som cytokiner, kemokiner og vækstfaktorer, og den spiller en væsentlig rolle som et biokemisk og biomekanisk signaleringsmedie, hvor et dynamisk samspil mellem vævsceller og proteoglykaner kan udløse forskellige cellulære reaktioner, der er afgørende for bl.a. vævscellernes differentiering, homøostase og styring af programmeret celledød (apoptose) (Frantz et al. 2010; Yue 2014; Kim et al. 2011; Park et al. 2016).
Ud fra dette kan det antages, at opretholdelse af en sund, funktionel vævsstruktur er forbundet med både proteoglykanernes indflydelse på vævscellernes regulerings- og styringsfunktioner og en nøje regulering af de biokemiske forhold i den ekstracellulære matrix. Det er i denne sammenhæng, at der muligvis kan opstå systemisk forstyrrelse i vævet baseret på en latent acidose.
Alle cellulære processer involverer biokemiske interaktioner på cellemembranens overflade, og disse reaktioner involverer ofte proteoglykaners interaktion med cellen og/eller signalstoffer i den ekstracellulære matrix. Proteoglykanerne spiller derfor en afgørende rolle i forhold til bl.a. immunregulering og inflammation (Reijmers et al. 2020; Heindryckx and Li 2018; Stevens and Adachi 2007), hvor de tilsyneladende regulerer vævets inflammationsrespons ved at modulere aktiviteten af cytokiner, kemokiner, vækstfaktorer og enzymer involveret i inflammationsresponsen (Delehedde et al. 2002). Forstyrrelse i proteoglykan-aktiviteten ses ved mange livsstilsygdomme, hvor det menes, at kostvaner kan have en signifikant betydning i forhold til proteoglykans indflydelse på energimetabolisme og inflammationsudvikling (Pessentheiner et al. 2020). Flere studier har vist, at forstyrrelse i proteoglykan-aktiviteten er relateret til:
Udvikling af diabetes II
- Udvikling af kræft
- Fedme
- Gigtsygdomme
- Hjertekarsygdomme
Referencer for ovenstående: Young et al. 1992; Hiebert 2017; Pessentheiner et al. 2020; Schaefer et al. 2017; Theocharis et al. 2010; Merline et al. 2011; Winsz-Szczotka et al. 2014; Wang et al. 2019; Wight and Merrilees 2004; Zhuang et al. 2021; Kolset et al. 2020.
Det er proteoglykanernes interaktion med cytokiner og kemokiner sammen med deres indflydelse på cellemetabolismen i forhold til regulering af inflammationsreaktioner, der placerer dem i centrum ift. ovenstående livsstilssygdomme (Mulloy and Rider 2006; Rajarathnam and Desai 2020; Pessentheiner et al. 2020). Vævets kemiske miljø er derfor i den sammenhæng altafgørende for opretholdelsen af sunde kropsvæv. Proteoglykanernes tilpassede funktion er afhængig af deres molekylære struktur (Walimbe and Panitch 2019; Vormann and Goedecke 2002, 2006), som er følsom over for vævets syre/base-miljø (Vormann and Goedecke 2002, 2006). Det er her, der kan drages en forbindelse mellem en latent acidose, forstyrrelse i proteoglykanernes regulerende funktion og en pro-inflammatorisk tilstand i kropsvævet, som kan danne grundlaget for mange af de livsstilssygdomme, der er omtalt i foregående afsnit.
Urinsyre og dens betydning
Urinsyre er en af de kilder til cirkulerende brintioner, som trækker vævets syre/base-miljø mod en mere syrlig tilstand. Stoffet dannes bl.a. ved nedbrydning af to af de purinstof-baser, adenin og guanin, som findes i nukleinsyrerne DNA og RNA (Jin et al. 2012). Både kost, indtagelse af mad med et højt cellulært indhold, f.eks. kød og skaldyr, og naturlig nedbrydning af egne kropsceller er dermed kilder til urinsyredannelse (Francis and Hamrick 1984). Urinsyre dannes også ved motion og øget muskelaktivitet, hvor dannelsen af stoffet adenosin-mono-fosfat (AMP) og celleskader danner grundlag for urinsyreproduktion (ibid.). Motion kan i øvrigt resultere i kortvarigt høje urinsyrekoncentrationer i blodet, da bevægelse midlertidigt nedsætter nyrernes udskillelse af stoffet (Green and Fraser 1988).
I forhold til den traditionelle fortælling om syre/base-balancen er urinsyre mest omtalt i forbindelse med nyrestensdannelse og urinsyregigt (podagra), hvor der ved en urinsyrekoncentration i blodet større end 6,8 mg/dl dannes mononatriumurat-krystaller, som kan deponere sig i bl.a. ledbrusk, ledbånd og sener, hvor de forårsager inflammation (Francis and Hamrick 1984). Nyere forskning er dog begyndt at belyse urinsyrens centrale rolle i reguleringen af kroppens metabolisme, samt hvordan urinsyrens utilpassede egenskaber i en moderne kontekst er med til at skabe et potentielt farligt fysiologisk samspil, der viser sig at være en væsentlig faktor i forhold til udvikling af de såkaldte moderne, kroniske livsstilssygdomme, der omfatter bl.a.:
- Hypertension (højt blodtryk)
- Diabetes II
- Metabolisk syndrom
- Kroniske nyresygdomme
Referencer for ovenstående: Kanbay et al. 2016; Perlmutter 2022.
Det, der er interessant i den sammenhæng er, at mennesket er et af de få pattedyr, som ikke er i stand til at nedbryde urinsyre, og det giver anledning til at overveje, hvorfor vores fysiologi er anderledes end de fleste af vores artsfællers – og hvad de sundhedsmæssige konsekvenser af dette faktum er.
Historien om menneskets særlige forhold til urinsyre begynder i den såkaldte miocæntid (for ca. 23,5 mio. år siden), hvor der skete en række mutationer i en gensekvens, som koder for enzymet uricase. Mutationerne kulminerede i et tab af enzymets funktion for ca. 15 mio. år siden hos vores forfædre (Álvarez-Lario and Macarrón-Vicente 2010). Uricase er et leverenzym, der er involveret i nedbrydningen af urinsyre, og som produceres hos de fleste pattedyr, der findes på kloden i dag – dog på grund af de førnævnte mutationer ikke hos medlemmer af primatfamilien Hominoidea, de store menneskeaber, som inkluderer chimpanser, gorillaer, orangutanger og mennesker (Kratzer et al. 2014). For at kunne forstå, hvorfor disse genmutationer, der i dag giver anledning til sygdomsudvikling, ikke har resulteret i udryddelse af menneskeaberne gennem flere millioner års evolution, er det nødvendig at se på urinsyrens centrale betydning for fysiologien og forstå, hvordan den har tilført vores forfædre en evolutionær fordel og derfor stadig findes hos de nulevende efterkommere, inklusiv mennesker, hvor den nu udgør en trussel mod vores sundhed.
Som tidligere nævnt dannes urinsyre fra nedbrydning af purinstoffer fra kosten, fra egne døde celler og fra nedbrydning af stoffet AMP. Da mennesket mangler enzymet uricase, er gennemsnitskoncentrationen i blodet op til 10 gange højere end hos andre pattedyr (El Ridi and Tallima 2017). I nyrerne filtreres urinsyre til udskillelse, men op mod 90 % af den filtrerede mængde genabsorberes i nyrernes tubulussystem (ibid.) og bidrager til en relativt høj koncentration af stoffet i blodet sammenlignet med andre pattedyr. Normalværdien hos mennesket betragtes som værende mellem 4,1 og 8,6 mg/dl for mænd og mellem 2,9 og 7,2 for kvinder, men disse værdier anses ikke for at være optimale i forhold til nyere forskning, hvor der foreslås et maksimum på 5,0 for mænd og 2,0–4,0 for kvinder (Kuwabara et al. 2020).
Urinsyre påvirker kroppen på flere måder, og i forhold til moderne menneskers sundhed er påvirkningen tvetydig, da den har både positiv og negativ indflydelse på nogle af kroppens fundamentale fysiologiske processer:
- Har antioxidant aktivitet (uden for kropscellerne)
- Har oxiderende aktivitet (inde i cellerne)
- Har proinflammatorisk aktivitet
- Indgår i reguleringen af kroppens immunaktivitet
- Igangsætter ændringer i reguleringen af kroppens metabolisme
- Forårsager insulinresistens
- Forårsager en stigning i blodtrykket
Referencer for ovenstående: NERY et al. 2015; Kool et al. 2011; Kanbay et al. 2016; Lanaspa et al. 2020; Lima et al. 2015; Pasalic et al. 2012; Martínez-Reyes et al. 2020.
Nøglen til en forståelse af konsekvenserne ved urinsyrens tvetydige egenskaber er adgangen til kalorierig mad i en evolutionær kontekst (Kratzer et al. 2014; Johnson et al. 2005; Perlmutter 2022). Det er urinsyrens indflydelse på metabolismen og blodtrykket, der havde og stadig har en særlig betydning i forhold til menneskeracens udvikling og sundhed.
Urinsyres indflydelse på metabolismen
Menneskets fundamentale fysiologi har ikke ændret sig i ca. 10.000 år (Templeton 2010), hvilket betyder, at det moderne menneskes fysiologiske processer er tilpasset en tilværelse som nomadiske jæger/samlere i den sene stenalder. Problemerne opstår, når vores livsvilkår i dag stemmer ikke overens med de livsvilkår, som har dannet grundlaget for udviklingen af vores fysiologi.
Da vores forfædre tilbage i miocæntiden mistede evnen til at producere det urinsyrenedbrydende enzym uricase, skete det på et tidspunkt, hvor der var en global nedkøling (Caves Rugenstein et al. 2019), og for vores forfædre i Europa gav tabet af uricase en evolutionær fordel i det geografiske område, hvor nedkølingen begrænsede adgangen til kalorierig mad (Kratzer et al. 2014; Johnson et al. 2010). Dette skyldes, at urinsyre fungerer som en trigger for en række fysiologiske overlevelsesmekanismer, der sikrer vores fortsatte eksistens, når adgang til kalorierig mad er begrænset.
For mange pattedyrarter er fruktose en kaloriekilde, der er nødvendig for deres overlevelse, fordi fruktose er et tilgængeligt næringsstof, som kan metaboliseres hurtigt og effektivt i leveren, primært for at opbygge leverens glykogenreserver og danne fedt (Dholariya and Orrick 2022). Forskning har vist, at blodets urinsyrekoncentration stiger ved fruktoseindtag, da urinsyre dannes i forhold til fruktosemetabolismen (Tappy and Lê 2010; Hallfrisch 1990; Kaneko et al. 2017). Som konsekvens af blodets stigende koncentration af urinsyre pga. fruktoseindtag ændres kroppens metabolisme hen mod en overlevelsesstrategi i og med, at der sker en række fysiologiske ændringer:
- Effektivisering af fedtdannelse fra indtagelse af fruktose → sikrer dannelse af energireserver
- Stimulering af appetitten ved at skifte balancen mellem sult- og mæthedshormonerne ghrelin og leptin → øger mæthedspunktet og hæmmer den naturlige begrænsning af kalorieindtag
- Udvikling af insulinresistens → nedsætter cellernes energimetabolisme og virker derved energibesparende
- Øgning af blodtrykket (som følge af, at natriumudskillelsen og nitrogenoxids indflydelse på blodkarrene hæmmes) → kompenserer for evt. væsketab forbundet med vandmangel/tørke
Referencer for ovenstående: Kratzer et al. 2014; Johnson et al. 2010; Miranda et al. 2015; Johnson 2022; Shapiro et al. 2008; Perlmutter 2022.
Evolutionsmæssigt er konsekvensen af samspillet mellem de første to punkter en øgning af kroppens fedtdepoter, hvilket er fordelagtigt, når adgangen til næringsrig mad er periodevis begrænset – f.eks. når der skal opbygges et energilager for at kunne overleve vinteren, mens sensommerens og efterårets frugter er tilgængelige. For det moderne menneske, hvor adgangen til næringsrig mad for de fleste er ubegrænset, skaber samspillet mellem de første to punkter i listen ovenfor en dysregulering af kroppens metabolisme med overspisning og øget fedtvævsdannelse. Kombinationen af øget fedtvævsdannelse og det tredje punkt på listen, udvikling af insulinresistens, danner grundlaget for udvikling af det metaboliske syndrom.
Tilbageholdelse af natrium, som er det sidste punkt på listen, vil resultere i en øgning af blodtrykket, hvilket giver en evolutionsmæssig fordel, når kosten hovedsagelig består af natriumfattige elementer i form af frugt og blade, og hvor der periodevis er begrænset adgang til vand. Men for det moderne mennesker er højt blodtryk en uvelkommen tilstand med en dyster prognose – især i tilfælde, hvor de første tre punkter på listen har haft indflydelse og har skabt et fysiologisk scenarie præget af metabolisk dysregulering.
Forskere har dog påpeget, at det moderne menneskes eksponering for fruktose fra frugt ikke har den store betydning i forhold til urinsyredannelse og sygdomsudvikling, hvis indtaget af frugt ikke er overdrevet. Til gengæld er vores indtag af produkter, der indeholder majssirup og andre kilder til høje koncentrationer til fruktose, som anvendes hyppigt i mange former for madvarer, meget bekymrende (Johnson 2022). I denne anledning bør det nævnes, at de europæiske fødevaremyndigheder i 2017 ophævede et forbud mod anvendelsen af højfruktose-majssyrup (high fructose corn syrup – HFCS) i madvarer. Dette kan vise sig at være en alvorlig trussel til vores sundhed.
Konklusion

Atter viser videnskabelig forskning, at traditionel viden baseret på empiri har sin plads i en moderne kontekst, og at videnskaben med tiden vil bekræfte og forsvare de mere abstrakte og esoteriske teorier anvendt af en række behandlere gennem tiderne. Men videnskaben vil også bidrage med ny viden, der skaber en mere nuanceret forståelse af sundhed, sygdomme og behandlingsindsats.
Prøv Acid Balance kapsler fra Natur-Drogeriet A/S – en unik sammensætning af urter og mineraler, bl.a. zink, som bidrager til et normalt syre-base-stofskifte. Produktet indeholder derudover birkeblade, der støtter aktiviteten i leveren, nyrerne og tarmkanalen, og djævleklorod, som bidrager til at vedligeholde fleksible led og sener.

Frede Damgaard: Syre/base-balancen
Urinsyre er årsag til mange sygdomme
Multisygdom – hvad er det?
Syre/base-balancen – overblik over fødevarers værdier
Koralkalk: Et naturligt mineral, der genopretter kroppens syre/base-balance
Base te – de bedste basiske urter i en skøn blanding
Har du e-sans? Du er ikke alene…
Kilder
Álvarez-Lario B, Macarrón-Vicente J. Uric acid and evolution. I Rheumatology (Oxford, England) 49 (11), pp. 2010–2015. DOI: 10.1093/rheumatology/keq204.
Ankli B, Kyburz D, Hirschmann A, Hügle T, Manigold T, Berger CT, Daikeler T. Calcium pyrophosphate deposition disease: a frequent finding in patients with long-standing erosive gout. I Scandinavian Journal of Rheumatology 47 (2), 2018, pp. 127–130. DOI: 10.1080/03009742.2017.1332239.
Anon. Renal Regulation of Acid-Base Balance. Gold Coast Hospital. LibreTexts. Tilgængelig online på://med.libretexts.org/@go/page/10873, opdateret 1. januar 2022.
Arnett T. Regulation of bone cell function by acid-base balance. In The Proceedings of the Nutrition Society 62 (2) 2003, pp. 511–520. DOI: 10.1079/pns2003268.
Brandis K. Buffering. Gold Coast Hospital. LibreTexts. Tilgængelig online på https: //med.libretexts.org/Bookshelves/Anatomy_and_Physiology/Book%3A_Acid-base_Physiology_(Brandis)/02%3A_Control_of_Acid-Base_Balance/2.02%3A_Buffering, opdateret 1. januar 2022.
Brinkman JE, Sharma S. StatPearls. Physiology, Metabolic Alkalosis 2022. Treasure Island (FL).
Brown EB. Blood and tissue buffers. I Archives of Internal Medicine 116 (5) 1965, pp. 665–669. DOI: 10.1001/archinte.1965.03870050019005.
Bushinsky DA, Krieger NS. Acid–Base Balance and Bone Health. In Michael F. Holick, Jeri W. Nieves (Eds.): Nutrition and Bone Health. New York, NY: Springer New York, pp. 335–357, 2015.
Caves Rugenstein JK, Ibarra DE, von Blanckenburg F. Neogene cooling driven by land surface reactivity rather than increased weathering fluxes. I Nature 571 (7763) 2019, pp. 99–102. DOI: 10.1038/s41586-019-1332-y.
Dawson-Hughes B. Acid-base balance of the diet-implications for bone and muscle. In European journal of clinical nutrition 74 (Suppl 1), pp. 7–13, 2020. DOI: 10.1038/s41430-020-0691-7.
Delehedde M, Allain F, Payne SJ, Borgo R, Vanpouille C, Fernig DG, Deudon E. Proteoglycans in Inflammation. In Current Medicinal Chemistry -Anti- Inflammatory & Anti-Allergy Agents 1 (2), pp. 89–102 2002. DOI: 10.2174/1568014023355935.
Dholariya S J, Orrick JA. Biochemistry, Fructose Metabolism. StatPearls Publishing. Tilgængelig online på https: //www.ncbi.nlm.nih.gov/books/NBK576428/#!po=87.5000, tjekket 16. juni 2022.
DuBose TD. Reclamation of filtered bicarbonate. I Kidney international 38 (4), pp. 584–589 1990. DOI: 10.1038/ki.1990.246.
El Ridi R, Tallima H. Physiological functions and pathogenic potential of uric acid: A review. I Journal of Advanced Research 8 (5), pp. 487–493 2017. DOI: 10.1016/j.jare.2017.03.003.
Faure G, Daculsi G. Calcified tendinitis: a review. I Annals of the rheumatic diseases 42 Suppl 1, pp. 49–53 1983. DOI: 10.1136/ard.42.suppl_1.49.
Francis K, Hamrick ME. Exercise and uric Acid: implication in cardiovascular disease. I The Journal of Orthopaedic and Sports Physical Therapy 6 (1), pp. 34–39 1984. DOI: 10.2519/jospt.1984.6.1.34.
Frank AE, Wingo CS, Weiner ID. Effects of ammonia on bicarbonate transport in the cortical collecting duct. In American Journal of Physiology. Renal Physiology 278 (2) 2000, F219-26. DOI: 10.1152/ajprenal.2000.278.2.F219.
Frantz C, Stewart KM, Weaver VM. The extracellular matrix at a glance. I Journal of Cell Science 123 (Pt 24), pp. 4195–4200 2010. DOI: 10.1242/jcs.023820.
Green HJ, Fraser IG. Differential effects of exercise intensity on serum uric acid concentration. In Medicine and science in sports and exercise 20 (1), pp. 55–59 1988. DOI: 10.1249/00005768-198802000-00008.
Hallfrisch J. Metabolic effects of dietary fructose. In FASEB journal : official publication of the Federation of American Societies for Experimental Biology 4 (9), pp. 2652–2660 1990. DOI: 10.1096/fasebj.4.9.2189777.
Heindryckx F, Li JP. Role of proteoglycans in neuro-inflammation and central nervous system fibrosis. I Matrix Biology : Journal of the International Society for Matrix Biology 68-69, pp. 589–601 2018. DOI: 10.1016/j.matbio.2018.01.015.
Hiebert LM. Proteoglycans and Diabetes. In Current pharmaceutical design 23 (10), pp. 1500–1509 2017. DOI: 10.2174/1381612823666170125154915.
Hopkins Erin, Sanvictores T, Sharma S. StatPearls. Physiology, Acid Base Balance 2022. Treasure Island (FL).
Jin M, Yang F, Yang I, Yin Y, Luo JJ, Wang H, Yang XF. Uric acid, hyperuricemia and vascular diseases. I Frontiers in Bioscience (Landmark edition) 17 (2), pp. 656–669 2012. DOI: 10.2741/3950.
Johnson RJ. Nature Wants Us to Be Fat. The surprising science behind why we gain weight and how we can prevent – and reverse it. 1st ed. Dallas: Benbella Books 2022.
Johnson RJ, Andrews P, Benner SA, Oliver W. Theodore E. Woodward award. The evolution of obesity: insights from the mid-Miocene. I Transactions of the American Clinical and Climatological Association 121, 295-305 2010; discussion 305-8.
Johnson RJ, Titte S, Cade JR, Rideout BA, Oliver WJ, Uric acid, evolution and primitive cultures. I Seminars in Nephrology 25 (1), pp. 3–8 2005. DOI: 10.1016/j.semnephrol.2004.09.002.
Kanbay M, Jensen T, Solak Y, Le M, Roncal-Jimenez C, Rivard C et al. Uric acid in metabolic syndrome: From an innocent bystander to a central player. I European Journal of Internal Medicine 29, pp. 3–8 2016. DOI: 10.1016/j.ejim.2015.11.026.
Kaneko C, Ogura J, Sasaki S, Okamoto K, Kobayashi M, Kuwayama K et al. Fructose suppresses uric acid excretion to the intestinal lumen as a result of the induction of oxidative stress by NADPH oxidase activation. I Biochimica et biophysica acta. General subjects 1861 (3), pp. 559–566 2017. DOI: 10.1016/j.bbagen.2016.11.042.
Kim SH, Turnbull J, Guimond S. Extracellular matrix and cell signalling: the dynamic cooperation of integrin, proteoglycan and growth factor receptor. I The Journal of Endocrinology 209 (2), pp. 139–151 2011. DOI: 10.1530/JOE-10-0377.
Koeppen BM. The kidney and acid-base regulation. I Advances in Physiology Education 33 (4), pp. 275–281 2007. DOI: 10.1152/advan.00054.2009.
Kolset SO, Heier M, Retterstøl K. Retensjon av lipoproteiner i årevegg – mulig mål for behandling? I Tidsskrift for den Norske laegeforening : tidsskrift for praktisk medicin, ny raekke 140 (10) 2020. DOI: 10.4045/tidsskr.19.0803.
Kool M, Willart MAM, van Nimwegen M, Bergen I, Pouliot P, Virchow JC et al. An unexpected role for uric acid as an inducer of T helper 2 cell immunity to inhaled antigens and inflammatory mediator of allergic asthma. I Immunity 34 (4), pp. 527–540 2011. DOI: 10.1016/j.immuni.2011.03.015.
Kratzer JT, Lanaspa MA, Murphy MN, Cicerchi C, Graves CL, Tipton PA et al. Evolutionary history and metabolic insights of ancient mammalian uricases. I Proceedings of the National Academy of Sciences of the United States of America 111 (10), pp. 3763–3768 2014. DOI: 10.1073/pnas.1320393111.
Kuwabara M, Hisatome I, Niwa K, Bjornstad P, Roncal-Jimenez CA, Andres-Hernando A et al. The Optimal Range of Serum Uric Acid for Cardiometabolic Diseases: A 5-Year Japanese Cohort Study. I Journal of Clinical Medicine 9 (4) 2020. DOI: 10.3390/jcm9040942.
Lanaspa MA, Andres-Hernando A, Kuwabara M. Uric acid and hypertension. I Hypertension research : official journal of the Japanese Society of Hypertension 43 (8), pp. 832–834 2020. DOI: 10.1038/s41440-020-0481-6.
Lima WG, Martins-Santos MES, Chaves VE. Uric acid as a modulator of glucose and lipid metabolism. I Biochimie 116, pp. 17–23 2015. DOI: 10.1016/j.biochi.2015.06.025.
Maiuolo J, Oppedisano F, Gratteri S, Muscoli C, Mollace V. Regulation of uric acid metabolism and excretion. I International Journal of Cardiology 213, pp. 8–14 2016. DOI: 10.1016/j.ijcard.2015.08.109.
Martínez-Reyes CP, Manjarrez-Reyna AN, Méndez-García LA, Aguayo-Guerrero JA, Aguirre-Sierra B, Villalobos-Molina R et al. Uric Acid Has Direct Proinflammatory Effects on Human Macrophages by Increasing Proinflammatory Mediators and Bacterial Phagocytosis Probably via URAT1. I Biomolecules 10 (4) 2020. DOI: 10.3390/biom10040576.
Merline R, Moreth K, Beckmann J, Nastase MV, Zeng-Brouwers J, Tralhão JG et al. Signaling by the matrix proteoglycan decorin controls inflammation and cancer through PDCD4 and MicroRNA-21. I Science Signaling 4 (199) 2011, ra75. DOI: 10.1126/scisignal.2001868.
Miklos B, Agnes A. Metabolic Diseases and Crystal Induced Arthropathies Technic of Non-Staining Histologic Sections – A Comparative Study of Standard Stains and Histochemical Reactions. I Clin Arch Bone Joint Dis 1 (2) 2018. DOI: 10.23937/cabjd-2017/1710007.
de Miranda JA, Almeida GG, Martins RIL, Cunha MB, Belo VA, dos Santos JET al. O papel do ácido úrico na resistência insulínica em crianças e adolescentes com obesidade. I Revista paulista de pediatria : orgao oficial da Sociedade de Pediatria de Sao Paulo 33 (4), pp. 431–436 2015. DOI: 10.1016/j.rpped.2015.03.009.
Mulloy B, Rider CC. Cytokines and proteoglycans: an introductory overview. I Biochemical Society transactions 34 (Pt 3), pp. 409–413 2006. DOI: 10.1042/BST0340409.
Nakamura Motonobu, Shirai A, Yamazaki O, Satoh N, Suzuki M, Horita S et al. Roles of renal proximal tubule transport in acid/base balance and blood pressure regulation. I BioMed research international 2014, p. 504808 2014. DOI: 10.1155/2014/504808.
Nery RA. Kahlow BS, Skare TL, Tabushi FI, Castro A do A.: Uric acid and tissue repair. In Arquivos Brasileiros de Cirurgia Digestiva : ABCD = Brazilian Archives of Digestive Surgery 28 (4), pp. 290–292 2015. DOI: 10.1590/S0102-6720201500040018.
Park PW, Hayashida K, Aquino RS, Jinno A. Proteoglycans. I : Encyclopedia of Cell Biology: Elsevier, pp. 271–278 2016.
Pasalic D, Marinkovic N, Feher-Turkovic Lana. Uric acid as one of the important factors in multifactorial disorders – facts and controversies. I Biochemia Medica 22 (1), pp. 63–75 2012.
Patel S, Sharma S. StatPearls. Respiratory Acidosis. Treasure Island (FL) 2022.
Perlmutter D. Drop Acid. London: Yellow Kite 2022.
Perrimon N, Bernfield M. Cellular functions of proteoglycans–an overview. I Seminars in cell & developmental biology 12 (2), pp. 65–67 2001. DOI: 10.1006/scdb.2000.0237.
Pessentheiner AR, Ducasa GM, Gordts PLSM. Proteoglycans in Obesity-Associated Metabolic Dysfunction and Meta-Inflammation. I Frontiers in Immunology 11, p. 769 2020. DOI: 10.3389/fimmu.2020.00769.
Rajamäki K, Nordström T, Nurmi K, Åkerman KEO, Kovanen PT, Öörni K, Eklund KK. Extracellular acidosis is a novel danger signal alerting innate immunity via the NLRP3 inflammasome. I The Journal of Biological Chemistry 288 (19), pp. 13410–13419 2013. DOI: 10.1074/jbc.M112.426254.
Rajarathnam K, Desai UR. Structural Insights Into How Proteoglycans Determine Chemokine-CXCR1/CXCR2 Interactions: Progress and Challenges. I Frontiers in Immunology 11, p. 660 2020. DOI: 10.3389/fimmu.2020.00660.
Ralph Schumacher H. Crystal-induced arthritis: An overview. In The American Journal of Medicine 100 (2), 46S-52S 1996. DOI: 10.1016/s0002-9343(97)89546-0.
Reijmers RM, Troeberg L, Lord MS, Petrey AC. Editorial: Proteoglycans and Glycosaminoglycan Modification in Immune Regulation and Inflammation. I Frontiers in immunology 11, p. 595867 2020. DOI: 10.3389/fimmu.2020.595867.
Renaudin F, Orliaguet L, Castelli F, Fenaille F, Prignon A, Alzaid F et al. Gout and pseudo-gout-related crystals promote GLUT1-mediated glycolysis that governs NLRP3 and interleukin-1β activation on macrophages. I Annals of the Rheumatic Diseases 79 (11), pp. 1506–1514 2020. DOI: 10.1136/annrheumdis-2020-217342.
Ryan LM, McCarty DJ. Understanding inorganic pyrophosphate metabolism: toward prevention of calcium pyrophosphate dihydrate crystal deposition. I Annals of the Rheumatic Diseases 54 (12), pp. 939–941 1995. DOI: 10.1136/ard.54.12.939.
Samuel TR. Who Is Balancing: Is It RBC or Acid-Base Status. In A. Tombak (Ed.): Erythrocyte. London: IntechOpen 2019.
Schaefer L, Tredup C, Gubbiotti MA, Iozzo RV. Proteoglycan neofunctions: regulation of inflammation and autophagy in cancer biology. I The FEBS journal 284 (1), pp. 10–26 2017. DOI: 10.1111/febs.13963.
Shapiro A, Mu W, Roncal C, Cheng KY, Johnson RJ, Scarpace PJ. Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding. I American Journal of Physiology. Regulatory, integrative and comparative physiology 295 (5), R1370-5 2008. DOI: 10.1152/ajpregu.00195.2008.
Shekhter AB. Connective tissue as an integral system: role of cell-cell and cell-matrix interactions. I Connective Tissue Research 15 (1-2), pp. 23–31 1886. DOI: 10.3109/03008208609001970.
Skelton LA, Boron WF, Zhou Y. Acid-base transport by the renal proximal tubule. I Journal of Nephrology 23 (0 16), S4-18 2010.
Sousa APD, Moura C, Da Hora PR, Santiago M. Calcium crystal-associated arthropathy mimicking a febrile systemic inflammatory disease in an elderly patient. I Oxford Medical Case Reports 2019 (5), omz030. DOI: 10.1093/omcr/omz030.
Stevens RL, Adachi R. Protease-proteoglycan complexes of mouse and human mast cells and importance of their beta-tryptase-heparin complexes in inflammation and innate immunity. I Immunological Reviews 217, pp. 155–167 2007. DOI: 10.1111/j.1600-065X.2007.00525.x.
Tappy L, Lê KA. Metabolic effects of fructose and the worldwide increase in obesity. I Physiological Reviews 90 (1), pp. 23–46 2010. DOI: 10.1152/physrev.00019.2009.
Templeton AR. Has Human Evolution Stopped? I Rambam Maimonides Medical Journal 1 (1) 2010. DOI: 10.5041/RMMJ.10006.
Theocharis AD, Skandalis SS, Tzanakakis GN, Karamanos NK. Proteoglycans in health and disease: novel roles for proteoglycans in malignancy and their pharmacological targeting. I The FEBS Journal 277 (19), pp. 3904–3923 2010. DOI: 10.1111/j.1742-4658.2010.07800.x.
Townsend CM. Wound Healing. I C. M. Townsend (Ed.): Sabiston Textbook of Surgery: The Biological Basis of Modern Surgical Practice, 21st Edition.: Elsevier 2022.
Vormann, Jürgen; Goedecke, Thomas (2002): Latent acidosis: Overacidification as a cause of chronic disases. The physiological importance of a well-balanced acid-base equilibrium and preventive aspects of a diet rich in bases. In Schweizerische Zeitschrift für Ganzheitsmedizin / Swiss Journal of Integrative Medicine 14 (2), pp. 90–96.
Vormann J, Goedecke T. Acid-base homeostasis: Latent acidosis as a cause of chronic diseases. I Schweizerische Zeitschrift für Ganzheitsmedizin / Swiss Journal of Integrative Medicine 18 (5) 2006.
Wachman A, Bernstein DS. Diet and Osteoporosis. I The Lancet 291 (7549), pp. 958–959 1968. DOI: 10.1016/s0140-6736(68)90908-2.
Walimbe T, Panitch A. Proteoglycans in Biomedicine: Resurgence of an Underexploited Class of ECM Molecules. I Frontiers in Pharmacology 10, p. 1661 2019. DOI: 10.3389/fphar.2019.01661.
Wang X, Lu Y, Xie Y, Shen J, Xiang M. Emerging roles of proteoglycans in cardiac remodeling. I International Journal of Cardiology 278, pp. 192–198 2019. DOI: 10.1016/j.ijcard.2018.11.125.
Weiner ID, Mitch WE, Sands JM, Urea and Ammonia Metabolism and the Control of Renal Nitrogen Excretion. In Clinical Journal of the American Society of Nephrology : CJASN 10 (8), pp. 1444–1458 2014. DOI: 10.2215/CJN.10311013.
Weiner ID, Verlander JW. Renal ammonia metabolism and transport. I Comprehensive Physiology 3 (1), pp. 201–220 2013. DOI: 10.1002/cphy.c120010.
Wight TN, Merrilees MJ. Proteoglycans in atherosclerosis and restenosis: key roles for versican. I Circulation Research 94 (9), pp. 1158–1167 2004. DOI: 10.1161/01.RES.0000126921.29919.51.
Winsz-Szczotka K, Komosińska-Vassev K, Kuźnik-Trocha K, Gruenpeter A, Lachór-Motyka I, Olczyk K. Influence of proteolytic-antiproteolytic enzymes and prooxidative-antioxidative factors on proteoglycan alterations in children with juvenile idiopathic arthritis. I Clinical Biochemistry 47 (9), pp. 829–834 2014. DOI: 10.1016/j.clinbiochem.2014.01.027.
Young ID, Ailles L, Narindrasorasak S, Tan R, Kisilevsky R. Localization of the basement membrane heparan sulfate proteoglycan in islet amyloid deposits in type II diabetes mellitus. I Archives of Pathology & Laboratory Medicine 116 (9), pp. 951–954 1992.
Yue B. Biology of the extracellular matrix: an overview. I Journal of Glaucoma 23 (8 Suppl 1), S20-3 2014. DOI: 10.1097/IJG.0000000000000108.
Zacchia M, Capolongo G, Rinaldi L, Capasso G. The importance of the thick ascending limb of Henle’s loop in renal physiology and pathophysiology. I International Journal of Nephrology and Renovascular Disease 11, pp. 81–92 2018. DOI: 10.2147/IJNRD.S154000.
Zhuang L, Ge Y, Zong X, Yang Q, Zhang R, Fan Q, Tao R. High Proteoglycan Decorin Levels Are Associated With Acute Coronary Syndrome and Provoke an Imbalanced Inflammatory Response. I Frontiers in Physiology 12, p. 746377 2021. DOI: 10.3389/fphys.2021.746377.


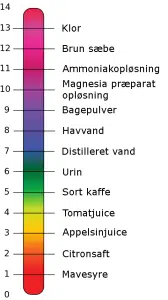 Figur 1. pH-skalaen
Figur 1. pH-skalaen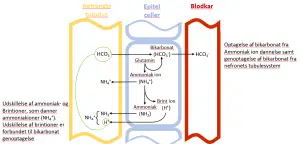
 Podagra er karakteriseret ved deponering af mononatriumurat-krystaller i bl.a. i ledbrusk, ledbånd og sener
Podagra er karakteriseret ved deponering af mononatriumurat-krystaller i bl.a. i ledbrusk, ledbånd og sener Udvikling af diabetes II
Udvikling af diabetes II